Centre de Culture Scientifique, Technique et Industrielle de Guadeloupe
Astronomie/Physique

Astronomie
L’astronomie est l’étude des astres. Depuis des millénaires les hommes ont levés les yeux au ciel afin de mieux comprendre la mécanique céleste. Que ce soit pour se repérer sur Terre, mesurer le temps, chercher de la vie ou plus récemment mieux comprendre notre propre Terre en étudiant d’autres planètes.
Les rendez-vous de l’astronomie, les différentes activités en astronomie organisées par Archipel des Sciences.
Les évènements de l’astronomie, les évènements astronomiques concernant la Guadeloupe.
Retrouvez toutes les observations du mois en Guadeloupe dans Syans é nou, la newsletter d’Archipel des Sciences.
Découvrez nos expositions « Initiation à l’astronomie » et « La recherche de la vie dans l’univers » , ainsi que celles du Centre National d’Etudes Spatiales (CNES), « Question d’espace » et « Promenade spatiale au fil des ondes » .
Regardez les vidéos d’Archipel des Sciences « C’est là que nous vivons » et « Comment voyons nous l’univers » pour donner une idée de l’immensité de l’espace, et pourquoi pas amorcer un questionnement sur la vie dans l’univers.
Le ciel de Guadeloupe aujourd’hui (Source : Time and Date)
Lune aujourd'hui
moon-phases-dates-g97ag8097908y5h112
night-dates-g97ag8097908y5h112
Taille apparentes des planètes
Calendrier des pluies d'étoiles filantes à Pointe-à-Pitre
Plus d'informations sur les planètes sur le site Time and Date
Découvrez plus d'informations en vous identifiant si vous êtes déjà adhérent, ou, dans le cas contraire, en adhérant à Archipel des Sciences.
Le ciel de Saint-Martin aujourd'hui
L’aube précède le lever du soleil. Elle se caractérise par la présence de lumière du jour, bien que le soleil soit encore au-dessous de l’horizon. On distingue :
- l’aube astronomique est le moment après lequel le ciel n’est plus complètement noir, qui commence formellement au moment où le soleil est 18° sous l’horizon au matin.
- l’aube nautique est le moment à partir duquel il y a juste assez de lumière pour que l’horizon et certains objets soient identifiables, que l’on définit formellement comme le moment à partir duquel le soleil est 12° sous l’horizon au matin.
- l’aube civile est le moment à partir duquel il y a suffisamment de lumière pour que les objets environnants soient identifiables et que les activités de commerce puissent commencer. Elle est définie de façon formelle comme le moment à partir duquel le soleil est à 6° sous l’horizon le matin. L’horizon est très bien visible durant cette période et seules les étoiles et les planètes les plus brillantes sont visibles.
L’aube ne doit pas être confondue avec le lever du soleil, qui est le moment où le bord supérieur du soleil apparaît au-dessus de l’horizon.
Le crépuscule est la lueur atmosphérique présente après le coucher du soleil. Comme pour l’aube, on distingue :
- le crépuscule civil : le centre du Soleil est situé à moins de 6° sous la ligne d’horizon. Il subsiste encore suffisamment de lumière pour que la plupart des activités ne nécessitent pas de sources de lumières artificielle. L’horizon est très bien visible durant cette période et seules les étoiles et les planètes les plus brillantes sont visibles.
- le crépuscule nautique : le centre du Soleil est situé entre 6° et 12° sous l’horizon. En mer, la ligne d’horizon est toujours visible permettant ainsi de faire un point astronomique avec les étoiles.
- le crépuscule astronomique : le centre du Soleil est situé entre 12° et 18° sous l’horizon. L’obscurité est presque complète et l’on ne peut plus discerner l’horizon. La Voie lactée commence à apparaître. On peut même commencer à voir à l’œil nu les étoiles et les planètes les moins lumineuses, à moins que la Lune n’illumine le ciel. Cependant, les galaxies, les nébuleuses et les amas globulaires nécessitent une obscurité totale, c’est-à-dire lorsque le Soleil se trouve à plus de 18° sous l’horizon. La fin du crépuscule astronomique marque le début de la nuit complète.
Le zénith est un des points d’intersection de la verticale d’un lieu donné et de la sphère céleste. Le point d’intersection qui se trouve au-dessus de la Terre est le zénith tandis que celui qui se trouve aux antipodes est le nadir.
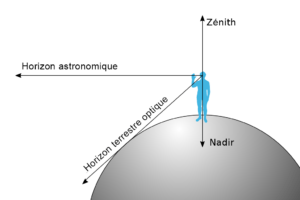
Le zénith est le point sur la verticale au-dessus de notre tête tandis que le nadir est le point sur la verticale situé sous nos pieds. En coordonnées horizontales, l’axe zénith-nadir est perpendiculaire au plan de l’horizon céleste, tandis que le zénith et le nadir sont les pôles du grand cercle de l’horizon. Le méridien céleste du lieu passe par ces pôles que sont le zénith et le nadir.
Le zénith ne devrait pas être confondu avec le point le plus élevé de la trajectoire d’un astre dans le ciel (par exemple le Soleil), appelé point de culmination, car le Soleil ne passe au zénith que les jours où sa déclinaison est égale à la latitude du lieu, soit deux fois par an entre les tropiques et une fois par an sur les tropiques. En dehors de la zone intertropicale, le Soleil ne passe jamais au zénith.
L’axe de rotation de la Terre est incliné de 23,5 degrés par rapport au plan de son orbite, et l’orientation de cet axe est à peu près fixe dans l’espace. Ainsi, selon la position de la Terre le long de son orbite, c’est-à-dire selon le moment de l’année, le Soleil plombe davantage sur l’un ou l’autre des deux hémisphères de notre planète.
À un endroit donné sur Terre, le Soleil nous apparaît donc plus ou moins haut dans le ciel en milieu de journée. Cette variation annuelle de la hauteur du Soleil est à l’origine du cycle des saisons.
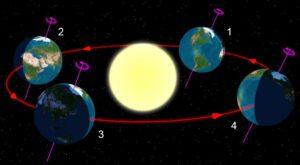
Au cours de l’année, la déclinaison du Soleil, à savoir l’angle entre le Soleil et l’équateur céleste (projection de l’équateur terrestre sur la sphère céleste) varie entre +23,5° et -23,5°, qui correspondent respectivement aux latitudes des tropiques du Cancer, dans l’hémisphère nord, et du Capricorne, dans l’hémisphère sud.
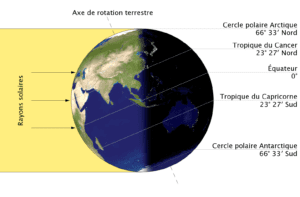
Les équinoxes caractérisent les moments de l’année où la déclinaison apparente du Soleil est nulle. Autrement dit, le Soleil est précisément à la verticale au-dessus de l’équateur de la Terre. Quant aux solstices, ils définissent le passage du Soleil directement à la verticale au-dessus du tropique du Cancer ou du tropique du Capricorne, soit une déclinaison de + ou -23,5°.
Ces événements astronomiques se produisent deux fois par an et sont inversés, comme les saisons, dans les hémisphères nord et sud. Ainsi, les équinoxes ont lieu une première fois entre le 20 et le 22 mars, une seconde fois entre le 21 et 23 septembre. Dans l’hémisphère nord, l’équinoxe de mars est l’équinoxe de printemps (ou équinoxe vernal), celle de septembre est l’équinoxe d’automne.
Pendant les équinoxes, le Soleil se lève presque exactement à l’est et se couche presque exactement à l’ouest. Étant au-dessus de l’équateur, il éclaire les hémisphères nord et sud de façon symétrique sur toute sa trajectoire. Les équinoxes se traduisent par une durée égale du jour et de la nuit (12 h), mais en pratique, le jour reste toujours un peu plus long, à cause notamment de la réfraction des rayons du Soleil par l’atmosphère, ceci même après qu’il ait basculé sous l’horizon.
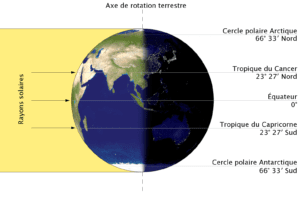
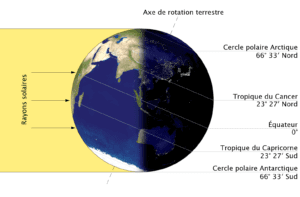
Les solstices se produisent une première fois le 20 ou le 21 juin, une seconde fois le 21 ou le 22 décembre. En Guadeloupe, le solstice de juin marque le solstice d’été. Le Soleil passe au zénith au-dessus du tropique du Cancer et éclaire l’hémisphère nord pendant une durée maximale : c’est donc le jour le plus long de l’année pour cette partie du globe. Le solstice de décembre correspond quant à lui au solstice d’hiver. Le Soleil passe au zénith au-dessus du tropique du Capricorne et éclaire l’hémisphère nord pendant une durée minimale : c’est donc le jour le plus court pour cette partie du globe.
 |
 |
| Calendrier des saisons à Pointe-à-Pitre. | Calendrier des saisons à Saint-Martin. |
Phase d’une planète ou d’un satellite naturel
La phase d’une planète ou d’un satellite naturel désigne l’apparence de sa partie éclairée telle qu’elle est perçue par un observateur suffisamment éloigné pour voir cet objet dans son ensemble. Ce terme, plutôt réservé aux corps d’aspect globalement sphérique, est une généralisation des phases de la Lune. La notion d’angle de phase est directement issue de celle de phase d’un corps céleste.
Depuis la Terre, seuls les objets orbitant à une distance du Soleil inférieure à celle de la Terre peuvent présenter la totalité des phases possibles, y compris les croissants, car ils peuvent être vus sous tous les angles de phase, de 0 à 180°. C’est notamment le cas de Mercure, Vénus et la Lune.

En revanche, les objets qui orbitent à une distance au Soleil toujours supérieure à celle de la Terre ne peuvent être vus depuis notre planète que sous des angles de phase inférieurs à 90°, et ne présentent donc jamais de croissants. Mars est ainsi toujours vue pleine ou gibbeuse, étant éclairée à au moins 87 %.
La phase peut être définie quantitativement comme le rapport de l’aire de la fraction éclairée du disque (lunaire ou planétaire) sur l’aire totale du disque. Ce rapport, généralement noté k, est relié à l’angle de phase noté i par la formule :
Ainsi à un angle de phase de 0° correspond une phase de 1, c’est-à-dire 100 % du disque éclairé.
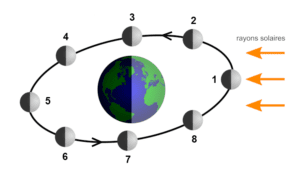
La phase de la Lune ou, moins communément, phase lunaire désigne une portion de Lune illuminée par le Soleil et vue à partir de la Terre. Cette dernière correspond à la partie de la Lune orientée à la fois vers la Terre et vers le Soleil. Puisque la Lune se déplace en orbite autour de la Terre, les phases lunaires changent d’une journée à l’autre, complétant un cycle au bout d’une lunaison, d’une durée d’environ 29,5 jours. La Lune présentant toujours la même « face » envers la Terre et son orbite étant peu inclinée, les phases lunaires présentent à peu près toujours les mêmes parties de la Lune d’un cycle à l’autre.
- 🌑 Nouvelle Lune : la Lune et le Soleil sont en conjonction par rapport à la Terre ; la Lune se trouve exactement entre le Soleil et la Terre ; elle n’apparaît donc pas dans le ciel de nuit, mais en journée et seule sa « face » cachée est illuminée.
- 🌒 Premier croissant : la surface éclairée augmente chaque jour jusqu’au premier quartier.
- 🌓 Premier quartier : la Lune est en quadrature Est ; il s’agit d’une demi-Lune.
- 🌔 Lune gibbeuse croissante : la phase entre le premier quartier et la pleine Lune ; la Lune commence à « briller » de plus en plus.
- 🌕 Pleine Lune : la Lune et le Soleil sont en opposition par rapport à la Terre ; la face visible est alors entièrement éclairée.
- 🌖 Lune gibbeuse décroissante : la phase entre la pleine Lune et le dernier quartier ; l’intensité lumineuse de la Lune décroît.
- 🌗 Dernier quartier : la Lune est en quadrature ouest ; il s’agit également d’une demi-Lune.
- 🌘 Dernier croissant : la surface éclairée diminue chaque jour jusqu’à la Nouvelle Lune suivante.
La lunaison est l’intervalle de temps séparant deux nouvelles lunes et dont la durée moyenne est de 29 jours 12 heures 44 minutes et 2,8 secondes.
La Lune tourne autour de la Terre en un peu plus de 27 jours (27 j 7 h 43 min 11,5 s), mais pendant cette révolution, la Terre avance d’environ 1/12e de tour sur son orbite autour du Soleil. Or comme la révolution de la Terre et de la Lune sont dans le même sens, cela se traduit par le fait que pour revenir à une même phase, la Lune doit faire sa révolution (27 j, et donc même position relativement à la Terre) plus 2 jours, ce qui en fait 29.
La durée de lunaison indiquée ci-dessus est une moyenne. La durée des lunaisons varie en effet au cours d’une année (de l’ordre de ±6 h) et même d’une année à l’autre.
 |
 |
 |
 |
 |
 |
 |
 |
|
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 1 |
La vidéo ci-dessous montrant l’orbite de la Lune autour de la Terre, permet de mieux comprendre le terme de lunaison (Source : NASA).
L’animation suivante montre un ensemble de vues simulées de la Lune, à partir de l’hémisphère nord, sur une période d’un mois, comme si une photographie avait été prise chaque jour. Elle permet de mettre en évidence les phases et le cycle lunaires. Le mouvement haut/bas de l’animation met en évidence le phénomène de libration lunaire (lente oscillation apparente de la Lune relativement à la Terre).

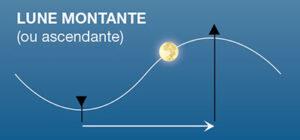
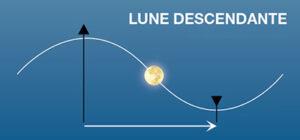
Attention : Il ne faut absolument pas confondre les phases de la Lune “croissantes et décroissantes” avec ce qu’on appelle la Lune “montante et la Lune descendante” qui est un concept qui n’a rien à voir avec les phases. Tout comme le Soleil, au cours de l’année et des saisons, qui passe plus ou moins haut dans le ciel par rapport à l’horizon, la Lune fait de même au cours de son cycle de la lunaison. Quand la Lune passe plus haut dans le ciel que la veille on dit que la Lune est montante. Si elle passe plus bas que la veille elle est alors descendante. La Lune peut être tout à la fois montante et croissante, montante et décroissante, descendante et croissante ou descendante et décroissante.
| Calendrier lunaire du mois à Pointe-à-Pitre | Calendrier lunaire du mois à Saint-Martin |
| Calendrier des phases lunaire à Pointe-à-Pitre | Calendrier des phases lunaire à Saint-Martin |
Que sont ascension droite et déclinaison d’un astre ?
Avant de parler en détail des coordonnées célestes, il est nécessaire de comprendre le concept de la sphère céleste. En termes simples, la sphère céleste est une sphère imaginaire qui entoure la Terre et représente l’ensemble du ciel tel qu’il est vu depuis notre planète. Au fur et à mesure que la Terre tourne, il semble que les étoiles et les autres objets se déplacent à travers la sphère céleste.
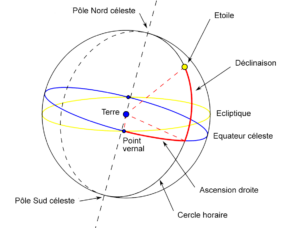
Voici quelques points de référence et lignes importants sur la sphère céleste :
- Equateur céleste : le cercle le long duquel le plan de l’équateur terrestre croise la sphère céleste. Il divise la sphère céleste en hémisphères nord et sud, tout comme le fait l’équateur terrestre.
- Ecliptique : le cercle le long duquel le plan orbital de la Terre croise la sphère céleste. En raison de l’inclinaison axiale de la Terre, l’écliptique et l’équateur céleste sont inclinés d’environ 23,5° l’un par rapport à l’autre.
- Pôle céleste nord : le point sur la sphère céleste directement au-dessus du pôle nord terrestre où l’axe de la Terre intersecte la sphère céleste. C’est un point fixe dans le ciel, et toutes les étoiles semblent tourner autour de lui dans le sens contraire des aiguilles d’une montre.
- Pôle céleste sud : le point sur la sphère céleste directement au-dessus du pôle sud terrestre où l’axe de la Terre intersecte la sphère céleste. Comme le pôle céleste nord, c’est un point fixe, et les étoiles semblent tourner autour de lui dans le sens des aiguilles d’une montre.
- Point vernal : le point où le Soleil traverse l’équateur céleste lors de l’équinoxe de Printemps.
Le système de coordonnées équatoriales décrit les positions des objets célestes par rapport à l’équateur céleste. Il utilise deux coordonnées principales : l’ascension droite et la déclinaison.
- L’ascension droite (AD) mesure la distance angulaire d’un objet vers l’est le long de l’équateur céleste, à partir du point vernal. L’ascension droite est l’équivalent céleste de la longitude terrestre. Pour des raisons historiques, elle est exprimée non pas en degrés mais en heures, minutes et secondes d’arc. Le ciel terrestre semble tourner de 360° en 24 heures ou de 15° en une heure. Par conséquent, le cercle complet de 360° de l’équateur céleste correspond à 24 heures d’ascension droite, et une heure d’ascension droite équivant à 15°. Ainsi, si un objet a une ascension droite de 6 heures, cela signifie qu’il est situé à 90° (15° × 6 heures) à l’est du point vernal le long de l’équateur céleste.
- La déclinaison (Dec) mesure la distance angulaire d’un objet au nord ou au sud de l’équateur céleste. C’est l’équivalent céleste de la latitude terrestre. La déclinaison est exprimée en degrés, allant de +90° (pôle céleste nord) à -90° (pôle céleste sud). Par exemple, si un objet a une déclinaison de +30°, cela signifie qu’il est positionné au tiers du chemin vers le nord à partir de l’équateur céleste.
Que sont l’altitude et l’azimut d’un astre ?
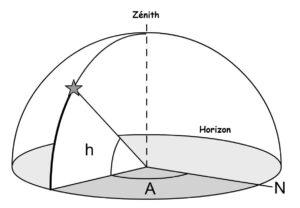
Le système de coordonnées horizontales est un système de coordonnées célestes utilisé en astronomie par un observateur au sol. Le système sépare le ciel en deux hémisphères : l’un situé au-dessus de l’observateur et l’autre situé au-dessous, caché par le sol. Le grand cercle séparant les deux hémisphères situe le plan horizontal, à partir duquel sont établis une altitude et un azimut, qui constituent les deux principales coordonnées de ce système.
- L’altitude ou hauteur (h sur la figure), est l’angle vertical entre le plan horizontal et l’objet visé. Il varie entre 0° (horizon) et 90° (zénith). Il est cependant possible d’obtenir des valeurs négatives lors d’une observation à partir d’un lieu élevé. Le point situé aux pieds de l’observateur (-90°) est appelé le nadir.
- L’azimut (A sur la figure) est déterminé par l’angle entre le nord ou le sud cardinal et la projection de la direction de l’objet observé sur le plan horizontal. Les azimuts sont généralement numérotés de 0° à 360° dans le sens horaire à partir du point cardinal choisi.
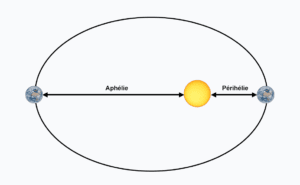
Qu’appelle t’on périhélie et ahélie ?
Le périhélie constitue le point où une planète est à la distance minimale du Soleil.
L’aphélie constitue le point où une planète est à la plus grande distance du Soleil.
La Terre ne décrit pas un cercle parfait autour du Soleil mais suit une ellipse, le Soleil occupant le foyer de l’ellipse. Lorsqu’elle est au périhélie, la Terre est à environ 0,983 unité astronomique (UA) de distance du Soleil (soit environ 147 millions de kilomètres), et lorsqu’elle est à l’aphélie, elle en est éloignée d’environ 1,017 UA (soit environ 152 millions de kilomètres).
Périhélie et aphélie de la Terre
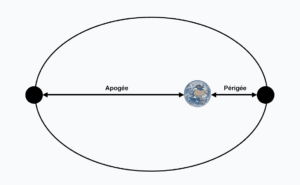
Qu’appelle t’on périgée et apogée ?
Le terme périgée correspond au point de l’orbite elliptique d’un astre ou d’un satellite artificiel le plus rapproché de la Terre lorsque celle-ci constitue un foyer de l’ellipse. Attention toutefois à ne pas confondre périgée et périhélie.
Le terme apogée correspond au point de l’orbite elliptique d’un astre ou d’un satellite artificiel le plus éloigné de la Terre lorsque celle-ci constitue un foyer de l’ellipse. Attention toutefois à ne pas confondre apogée et aphélie.
L’orbite de la Lune nous donne un exemple concret. Celle-ci en effet, est elliptique et la distance qui la sépare de la Terre varie de manière flagrante. Notez tout d’abord que la distance moyenne entre la Terre et la Lune est de 384 400 kilomètres. À son périgée, la Lune ne se trouve plus qu’à 356 500 kilomètres. À son apogée, la Lune se trouve à pas moins de 406 000 kilomètres.
Périgée et apogée de la Lune
Qu’est-ce qu’une occultation ?
Une occultation est le phénomène par lequel un astre (planète, lune, étoile, astéroïde…) est masqué totalement ou partiellement par un autre astre qui passe entre celui-ci et l’observateur. Ce phénomène est purement apparent et lié à l’observateur : en changeant de position à la surface de la Terre, le phénomène peut disparaître et ne plus être visible. Aucune interaction n’a lieu entre les astres impliqués.
L’éclipse solaire constitue un cas particulier d’occultation : la Lune occulte le Soleil. L’occultation peut être utilisée dans certains cas pour déterminer les caractéristiques d’un des deux astres.
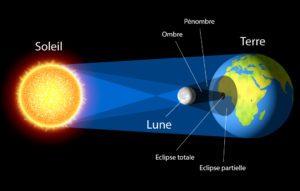
Qu’est ce qu’une éclipse solaire ?
Ce phénomène, qui impressionna tant nos ancêtres, est le produit d’une extraordinaire coïncidence cosmique. En effet, notre Lune est globalement 400 fois plus près de la Terre que le Soleil et 400 fois plus petite que lui. Les deux astres ont ainsi à peu près la même taille apparente dans le ciel, et le disque de la Lune peut se superposer plus ou moins parfaitement à celui du Soleil, occultant momentanément sa lumière. Pour qu’une éclipse soit totale, il faut toutefois que la Lune soit proche de nous. Installée sur une orbite elliptique, sa distance oscille de 357 000 à 405 000 kilomètres. Trop éloignée, elle paraît plus petite et laisse apparaître un anneau de lumière, ce que l’on nomme l’éclipse annulaire.
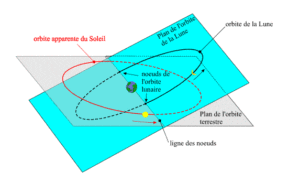
Ensuite, une éclipse solaire nécessite un deuxième miracle de la mécanique céleste : l’alignement parfait des trois astres, la Lune s’interposant entre la Terre et le Soleil. Sachant que notre satellite passe tous les 29,5 jours entre notre planète et le Soleil, lors de la nouvelle lune, on pourrait penser que le phénomène est fréquent. Hélas non, car les trois astres n’évoluent pas sur le même plan orbital. Si l’on admet que la Terre tourne autour du Soleil sur un plan horizontal, la Lune, elle, tourne de manière oblique autour de la Terre selon une trajectoire légèrement inclinée de 5 degrés par rapport à l’orbite terrestre. Elle passe donc généralement au-dessus et en-dessous de la ligne des éclipses (ou « ligne des nœuds »), qui joint de manière virtuelle le centre de la Terre à celui du Soleil. Celui-ci, d’ailleurs, ne croise cette ligne que deux fois par an.
La conjonction de tous ces paramètres est donc nécessaire pour avoir une éclipse solaire totale, un événement rare et de courte durée (pas plus de 8 minutes). Car s’il s’en produit en moyenne environ trois par an, cela ne touche qu’une étroite bande de notre planète, le plus souvent inhabitée (océans, pôles, déserts).
L’éclipse solaire partielle n’est que l’un des différents types d’éclipses que l’on peut observer. Contrairement à l’éclipse totale, elle ne fait pas « disparaître » le Soleil dans sa totalité : la Lune ne masque pas complètement le Soleil.
Une forme particulière de l’éclipse partielle est appelée éclipse solaire annulaire, car la partie visible de notre étoile prend la forme d’un anneau. Elle se produit lorsque la Lune se glisse entre la Terre et le Soleil et que le diamètre apparent de la Lune est légèrement inférieur au diamètre apparent du Soleil. La Lune alors, ne masque pas complètement le Soleil.
Qu’est ce qu’une éclipse lunaire ?
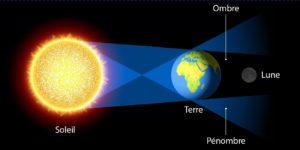
Une éclipse lunaire est une éclipse se produisant à chaque fois que la Lune se trouve dans l’ombre de la Terre. D’un point de vue lunaire, il s’agit d’une occultation du Soleil par la Terre.
Deux conditions sont requises pour que cela arrive. D’abord, la Lune doit être pleine, c’est-à-dire que, par rapport au Soleil, elle doit se trouver juste derrière la Terre. Toutefois, comme le plan orbital de la Lune est incliné de 5° par rapport au plan orbital de la Terre (l’écliptique), la plupart des pleines lunes se produisent quand la Lune est au Nord ou au Sud de l’ombre de la Terre. Ensuite, une deuxième condition pour qu’une éclipse lunaire advienne est que la Lune doit être à proximité d’un des deux points d’intersection que son orbite fait avec l’écliptique, les nœuds orbitaux.
Une éclipse totale se produit quand 100 % du globe lunaire est plongé durant un laps de temps dans le cône d’ombre de la Terre. La Lune prend alors des teintes cuivrées, plus ou moins sombres selon l’alignement Soleil-Terre-Lune.
Une éclipse lunaire partielle se produit uniquement quand une partie de la Lune entre dans l’ombre.
Une éclipse pénombrale se produit quand la Lune traverse la pénombre de la Terre. La pénombre ne provoque aucun obscurcissement notable de la surface lunaire. Certaines éclipses pénombrales sont totales, durant lesquelles la Lune se trouve entièrement dans la zone de pénombre de la Terre, mais elles sont rares.
Un transit est, en astronomie, le passage d’un objet céleste entre l’observateur et un autre objet. Le premier objet paraît alors se déplacer devant le deuxième. Si la situation de l’observateur n’est pas précisée, ce dernier se trouve implicitement sur la Terre.
Le terme « transit » est utilisé dans les cas où l’objet le plus proche possède un diamètre apparent nettement plus petit que l’objet le plus lointain. Lorsque l’objet s’intercalant possède un diamètre angulaire plus grand que le deuxième, le phénomène est une occultation. Si l’observateur est plongé dans l’ombre de l’objet transitant, il s’agit d’une éclipse. Lorsque le diamètre angulaire du plus proche objet est plus petit mais néanmoins voisin du deuxième objet, on parle d’éclipse annulaire.

Un exemple de transit implique le déplacement d’une planète entre la Terre et le Soleil, ce qui ne peut se produire qu’avec Mercure ou Vénus. Cependant, depuis les planètes plus lointaines, comme Mars, la Terre peut transiter devant le Soleil.

Le transit est aussi l’une des méthode pour détecter des exoplanètes.
Le système solaire
Le Système solaire est le système planétaire du Soleil, auquel appartient la Terre. Il est composé de cette étoile et des objets célestes gravitant autour d’elle : les huit planètes confirmées et leurs 214 satellites naturels connus, les cinq planètes naines et leurs neuf satellites connus, ainsi que des milliards de petits corps (la presque totalité des astéroïdes et autres planètes mineures, les comètes, les poussières cosmiques, etc.).
Le Système solaire fait partie de la galaxie appelée Voie lactée, où il réside dans le bras d’Orion. Il est situé à environ 26 100 années lumières (a.l.) du centre galactique, autour duquel il effectue une révolution en 225 à 250 millions d’années. Il s’est formé il y a un peu moins de 4,6 milliards d’années.
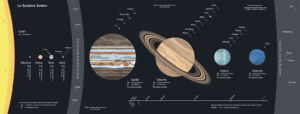
De façon schématique, le Système solaire est composé du Soleil, qui le domine gravitationnellement — il comprend 99,85 % de sa masse — et fournit de l’énergie par fusion nucléaire de l’hydrogène en hélium. Par ordre d’éloignement croissant à l’étoile, le Système solaire interne comprend quatre planètes telluriques internes, principalement composées de roches et de métaux (Mercure, Vénus, la Terre et Mars) puis une ceinture d’astéroïdes de petits corps rocheux, dont la planète naine Cérès. Plus loin orbitent les quatre planètes géantes du Système solaire externe : successivement deux géantes gazeuses constituées majoritairement d’hydrogène et d’hélium que sont Jupiter et Saturne — qui contiennent par ailleurs la grande majorité de la masse totale en orbite autour du Soleil — et deux géantes de glaces que sont Uranus et Neptune, contenant une plus grande part de substances volatiles comme l’eau, l’ammoniac et le méthane. Tous ont une orbite proche du cercle et sont concentrés près du plan de l’écliptique, le plan de rotation de la Terre.
Les objets situés au-delà de l’orbite de Neptune, dits transneptuniens, comprennent notamment la ceinture de Kuiper et le disque des objets épars, formés d’objets glacés. Quatre planètes naines glacées se trouvent dans la région transneptunienne et sont également appelées plutoïdes : Pluton — auparavant classée comme planète —, Hauméa, Makémaké et Éris. L’héliopause, limite magnétique du Système solaire, est définie par l’arrêt des vents solaires face aux vents du milieu interstellaire à une centaine d’unités astronomiques, tandis que la limite gravitationnelle du Système solaire se situe bien plus loin encore, jusqu’à une ou deux années-lumière du Soleil, vers laquelle une zone sphérique hypothétique, le nuage de Oort, pourrait exister et être la source des comètes à longue période.
Toutes les planètes du Système solaire à partir de la Terre possèdent des satellites en orbite — certains, tels que Ganymède et Titan, sont plus grands que Mercure —, tandis que chacune des quatre planètes externes est en outre entourée d’un système d’anneaux de poussières et d’autres particules, dont le plus proéminent est celui de Saturne.
Le Soleil est l’étoile du Système solaire. Dans la classification astronomique, c’est une étoile de type naine jaune.
Le Soleil fait partie de la galaxie appelée la Voie lactée et se situe à environ 26 100 a.l. du centre galactique, dans le bras d’Orion. Le Soleil orbite autour du centre galactique en une année galactique d’environ 250 millions d’années.
- Rayon équatorial : 696 342 km
- Applatissement : 9 × 10-6
- Volume : 1,412 × 1018 km3
- Masse : 1,988 5 × 1030 kg
- Masse volumique : 1 408 kg/m3
- Révolution : ~250 millions d’années
- Rotation : 27,28 jours
- Inclinaison sur l’écliptique : 7,25°
- Inclinaison sur le plan galactique : 67,23°
- Température en surface : 5 500 °C
- Composition photosphérique : principalement hydrogène (73,46 %) et hélium (24,85 %)
Le Soleil et le Système solaire sont issus de l’effondrement d’un nuage géant de gaz et de poussière il y a environ 4,5 milliards d’années. Depuis lors, le Soleil brule son combustible – l’hydrogène – et émet des particules et des rayonnements dans tout le Système solaire, dont de la lumière et de la chaleur.
Dans environ cinq milliards d’années, le Soleil aura épuisé son combustible et se gonflera. Il deviendra une étoile géante rouge, si grosse qu’elle avalera Mercure et Vénus, et possiblement la Terre. Plus tard, le Soleil soufflera son enveloppe externe : il ne restera plus qu’une naine blanche entourée de gaz. On appelle nébuleuses planétaires ces vestiges lumineux d’étoiles semblables au Soleil.
L’intérieur du Soleil étant inaccessible à l’observation, il faut principalement recourir à la théorie pour décrire les phénomènes qui s’y produisent et déterminer sa structure interne.
Cet intérieur est divisé en trois zones : le noyau, la zone radiative et la zone convective.
- Le noyau est la partie dans laquelle l’énergie du Soleil est créée grâce à des réactions nucléaires. La température y est extrêmement élevée, environ 15 millions de degrés. Cette région représente 25 pour cent du diamètre du Soleil et, du fait de sa grande densité, contient près de 60 pour cent de la masse totale de notre étoile.
- Autour du noyau vient ensuite la zone radiative qui représente 45 pour cent du rayon du Soleil. Dans cette région, l’énergie créée dans le noyau est transportée vers l’extérieur par les photons.
Ce mode de transport est très lent car les photons sont constamment absorbés puis réémis par toutes les particules présentes. On estime ainsi que le « temps » mis par un photon pour sortir du Soleil est de plusieurs centaines de milliers d’années, alors qu’il suffirait de quelques secondes s’il n’y avait pas d’obstacle en chemin. - Finalement, on arrive à la couche extérieure, la zone convective, qui représente 30 pour cent du diamètre solaire et où la température descend sous le million de degrés.
Dans cette couche, le transport d’énergie se fait par convection, c’est-à-dire par des mouvements d’ensemble de la matière présente. Le gaz chaud des profondeurs remonte ainsi vers la surface, libère de l’énergie en se refroidissant, puis replonge vers l’intérieur et ainsi de suite.
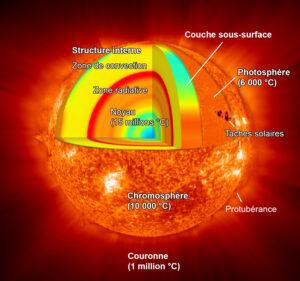
La partie externe du Soleil est divisée en 3 zones : la photosphère, la chromosphère et la couronne.
- La photosphère est une partie externe de l’étoile qui produit entre autres la lumière visible. Elle a une épaisseur d’environ 400 kilomètres. Sa température moyenne est de 6 000 K.
La lumière qui y est produite contient toutes les informations sur sa température, sa gravité de surface et sa composition chimique. La photosphère est maculée d’une granulation qui lui donne l’aspect d’une peau d’orange. Ce sont des sphères d’environ 1 000 km de diamètre, composées de gaz chaud remontant vers la surface à près de 500 mètres par seconde, qui lui donnent cet aspect. La surface atteinte, elles irradient leur énergie et, une fois refroidies, replongent dans l’étoile. Chaque sphère de granulation dure huit minutes en moyenne. - La chromosphère est épaisse d’environ 2 000 kilomètres où la densité décroit. Sa température augmente graduellement avec l’altitude, pour atteindre un maximum de 100 000 K à son sommet.
- La dernière couche atmosphérique est la couronne solaire. La densité continue à décroitre tandis que la température a continué à augmenter pour atteindre 106 K. La zone de transition n’a pas une altitude clairement définie. Grossièrement, elle forme un halo surplombant la chromosphère sous l’apparence de spicules et de filaments. Elle est le siège d’un mouvement chaotique et permanent.
Au dela de la couronne s’étend le milieu interplanétaire ou héliosphère qui englobe tout notre système solaire jusqu’à l’héliopause, interface avec le milieu interstellaire.
Mercure (0,4 ua) est la planète la plus proche du Soleil, ainsi que la plus petite (4 878 km de diamètre) et la moins massive avec un peu plus du vingtième de la masse terrestre.
- Rayon équatorial : 2 439,7 km
- Rayon polaire : 2 439,7 km
- Applatissement : 0
- Volume : 6,083 x 1010 km3
- Masse : 3,3011 x 1023 kg
- Masse volumique : 5 427 kg/m3
- Révolution : 87,969 jours
- Rotation : 58,645 jours
- Inclinaison sur l’écliptique : 0,035°
- Atmosphère : quasiment inexistante
- Température en surface : minimum -183 °C, maximum 427 °C
- Nombre de satellites : aucun
Vénus (0,7 ua) est la planète la plus proche de la Terre en taille (0,95 rayon terrestre) et en masse (0,815 masse terrestre), qui lui valent d’être parfois appelée sa « planète sœur ». Elle est également connue dans la culture occidentale sous le nom d’« étoile du berger ».
- Rayon équatorial : 6 051,8 km
- Rayon polaire : 6 051,8 km
- Applatissement : 0
- Volume : 9,2843 x 1011 km3
- Masse : 4,8675 x 1024 kg
- Masse volumique : 5,204 x 103 kg/m3
- Révolution : 224,667 jours
- Rotation : 243,023 jours (rétrograde)
- Inclinaison sur l’écliptique : 177,36°
- Atmosphère : composée à plus de 96 % de dioxyde de carbone
- Température en surface : 464 °C en moyenne
- Nombre de satellites : aucun
La Terre (1 ua) est la plus grande et la plus massive des planètes telluriques ainsi que la plus dense du Système solaire.
- Rayon équatorial : 6 378,137 km
- Rayon polaire : 6 356,752 km
- Applatissement : 0,003353
- Volume : 1,08321 x 1012 km3
- Masse : 5,9736 x 1024 kg
- Masse volumique : 5,515 x 103 kg/m3
- Révolution : 365,256 jours
- Rotation : 23 h 56 min 4 s
- Inclinaison sur l’écliptique : 23°
- Atmosphère : 78% diazote, 21% dioxygène & dioxyde de carbone, gaz rares (argon, néon, hélium…)
- Température en surface : 15 °C en moyenne
- Nombre de satellites : 1 (Lune)
Mars (1,5 ua) est deux fois plus petite que la Terre et Vénus, et fait seulement environ le dixième de la masse terrestre.
- Rayon équatorial : 3 396,2 km
- Rayon polaire : 3 376,2 km
- Applatissement : 0,00589
- Volume : 1,6318 x 1011 km3
- Masse : 6,4185 x 1023 kg
- Masse volumique : 3 933,5 kg/m3
- Révolution : 686,885 jours
- Rotation : 1,025 957 jours, soient 24,622962 h
- Inclinaison sur l’écliptique : 25,19°
- Atmosphère : atmosphère ténue, principalement composée de dioxyde de carbone
- Température en surface : −63 °C en moyenne
- Nombre de satellites : 2 (Phobos, Déimos)
Jupiter (5,2 ua), par ses 317 masses terrestres, est aussi massive que 2,5 fois toutes les autres planètes réunies et son diamètre avoisine les 143 000 kilomètres.
- Rayon équatorial : 71 492 km
- Rayon polaire : 66 854 km
- Aplatissement : 0,06487
- Volume : 1,43128 x 1015 km3
- Masse : 1,8986 x 1027 kg
- Masse volumique : 1 326 kg/m3
- Révolution : 11,86 ans
- Rotation : 9 h 55 min
- Inclinaison sur l’écliptique : 3,12°
- Atmosphère : 86% dihydrogène, 13% hélium
- Température en surface : −153 °C en moyenne
- Nombre de satellites : 92 (dont les satellites Gualiléens Ganymède, Callisto, Io et Europe)
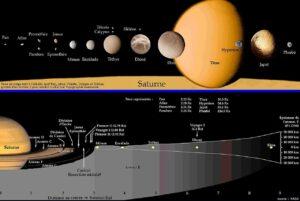
Saturne (9,5 ua) possède des caractéristiques similaires à Jupiter, telles que sa composition atmosphérique et sa puissante magnétosphère.
- Rayon équatorial : 60 268 km
- Rayon polaire : 54 359 km
- Aplatissement : 0,09796
- Volume : 8,2713 x 1014 km3
- Masse : 5,6846 x 1026 kg
- Masse volumique : 687,3 kg/m3
- Révolution : 29,44 ans
- Rotation : 10 h 33 min
- Inclinaison sur l’écliptique : 26,73°
- Atmosphère : 93% dihydrogène, 5% hélium
- Température en surface : −173 °C à -113 °C
- Nombre de satellites : 144 (dont Mimas, Encelade, Téthys, Dioné, Rhéa et Titan)
Uranus (19,2 ua) est la moins massive des planètes géantes, par ses 14 masses terrestres.
- Rayon équatorial : 25 559 km
- Rayon polaire : 24 973 km
- Aplatissement : 0,02293
- Volume : 6,83344 x 1013 km3
- Masse : 8,681 x 1025 kg
- Masse volumique : 1 270 kg/m3
- Révolution : 84.05 ans
- Rotation : 172 h 14 min 24 s (rétrograde)
- Inclinaison de l’axe : 97,8°
- Atmosphère : 83% dihydrogène, 15% hélium
- Température en surface : −224 °C
- Nombre de satellites : 27 (dont Titania, Obéron, Umbriel, Ariel et Miranda)
Neptune (30 ua) est la planète la plus éloignée du Soleil connue au sein du Système solaire.
- Rayon équatorial : 24 764 km
- Rayon polaire : 24 341 km
- Aplatissement : 0,0171
- Volume : 6,2526 x 1013 km3
- Masse : 1,0243 x 1026 kg
- Masse volumique : 1 638 kg/m3
- Révolution : 164,86 ans
- Rotation : 16 h 6 min 36 s
- Inclinaison de l’axe : 28,32°
- Atmosphère : 80% dihydrogène, 19% hélium
- Température en surface : −218 °C
- Nombre de satellites : 14 (dont Triton)
Les Planètes naines
C’est la seule planète naine située dans la ceinture d’astéroïdes, dont elle constitue environ un tiers de la masse totale. Son diamètre est d’environ 950 kilomètres.
- Pluton est une planète naine, la plus volumineuse connue dans le Système solaire (2 372 km de diamètre)
Premier objet transneptunien identifié, Pluton orbite autour du Soleil à une distance variant entre 30 et 49 unités astronomiques et appartient à la ceinture de Kuiper, ceinture dont il est (tant par la taille que par la masse) le plus grand membre connu.
- Hauméa est une planète naine transneptunienne (plutoïde) du Système solaire, située dans la ceinture de Kuiper.
Elle possède une forme allongée similaire à un ballon de rugby d’environ 2 100 × 1 700 × 1 100 km, d’après les calculs sur sa courbe de lumière, mais dont les mesures précises ne sont pas certaines.
- Makémaké est une planète naine transneptunienne (plutoïde) du Système solaire, située dans la ceinture de Kuiper.
Elle est la troisième plus grande planète naine et le troisième plus grand objet transneptunien connu, après Pluton et Éris, et le deuxième objet transneptunien le plus visible, là encore après Pluton.
- Eris est une planète naine du Système solaire, la plus massive (27 % de plus que Pluton) et la deuxième plus grande (2 326 km de diamètre, contre 2 370 pour Pluton).
Objet transneptunien, et plus précisément un objet du disque des objets épars, Éris est située au-delà de la ceinture de Kuiper.
| Calendrier des planètes à Pointe-à-Pitre | Calendrier des planètes à Saint-Martin |
| Courbes des planètes à Pointe-à-Pitre | Courbes des planètes à Saint-Martin |
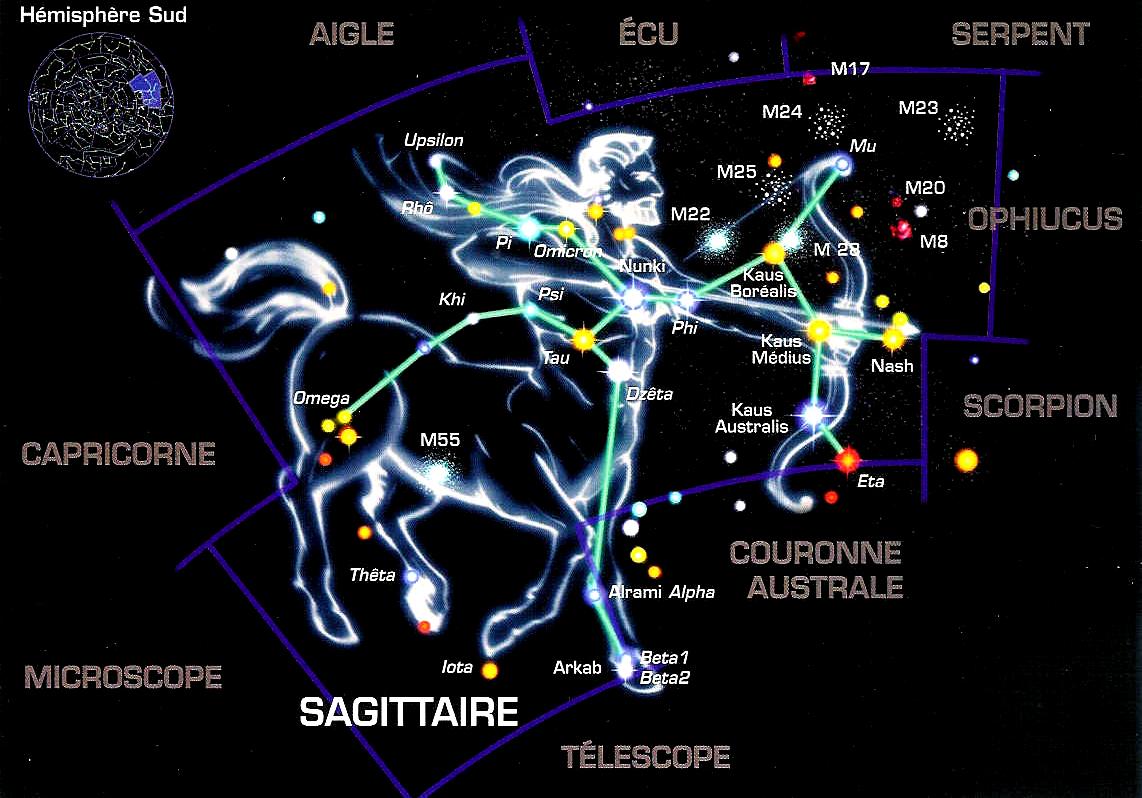
Une constellation est un ensemble d’étoiles dont les projections sur la voûte céleste sont suffisamment proches pour qu’une civilisation les relie par des lignes imaginaires, traçant ainsi une figure sur la voûte céleste. Une constellation est donc un astérisme particulier. Dans l’espace tridimensionnel, les étoiles d’une constellation sont ordinairement très dispersées, mais elles paraissent être regroupées dans le ciel nocturne.
Actuellement, l’Union astronomique internationale (UAI) divise le ciel en 88 constellations avec des frontières précises, pour que tout point du ciel appartienne à une constellation. Celles-ci sont substantiellement basées sur la tradition hellénique et pré-hellénique, transmise à travers l’ère médiévale. Différentes cultures ont reconnu des constellations différentes, bien que quelques-uns des regroupements les plus évidents aient tendance à réapparaître fréquemment, quoique sous des appellations différentes, comme par exemple Orion, la Grande Ourse et le Scorpion, à cause de leur brillance. Sauf mention contraire, le terme de constellation se réfère aux 88 constellations modernes.
Les constellations occidentales sont regroupées en deux parties, divisant le ciel en suivant plus ou moins les deux hémisphères terrestres, le ciel austral pour le sud et le ciel boréal pour le nord. Les constellations boréales sont les plus anciennes et correspondent au pan de ciel visible depuis les régions de la Méditerranée par les astronomes de l’Antiquité. Les constellations australes n’ont pas été nommées par les astronomes occidentaux avant au moins le XVe siècle. Elles servaient aussi, autrefois, de repères pour les marins partis en mer.
Les 88 constellations
Qu’appelle-t-on magnitude d’un astre ?
En astronomie, le terme magnitude est employé pour définir la luminosité d’un astre. Par le passé, on parlait de grandeur. Les étoiles les plus brillantes dans notre ciel, comme Sirius, Arcturus ou Véga, celles qui apparaissaient les premières à la tombée de la nuit, appartenaient à la première grandeur. Les plus faibles étaient classées dans la sixième grandeur. Et ce n’est que dans les années 1850 qu’un astronome britannique remarqua qu’un facteur 100 séparait la luminosité des étoiles de première et de sixième grandeur. D’où l’idée d’une nouvelle classification s’appuyant sur une échelle logarithmique.
L’échelle des magnitudes qu’emploient aujourd’hui les astronomes correspond à ce que l’on nomme une échelle logarithmique inverse. Le passage d’une magnitude à l’autre se fait par une multiplication de la luminosité par environ 2,5. Le terme inverse signifiant que, plus la magnitude est petite, voire négative, plus l’astre est lumineux.
Il faut aussi souligner que la luminosité d’une étoile telle que vue depuis la Terre correspond à ce que les astronomes qualifient de magnitude apparente que l’on note m. Pour qualifier la luminosité « intrinsèque » d’une étoile, ils parlent de magnitude absolue que l’on note M. La magnitude absolue correspond en réalité, par convention, à la luminosité qu’afficherait un astre s’il se trouvait à une distance de 10 parsecs (32,6 années lumière). Pour les objets du Système solaire, cette distance est ramenée à une unité astronomique.
Ainsi la magnitude absolue du Soleil est de 4,9 alors que sa magnitude apparente est de -26,7. Elle est près de 14 fois celle de la pleine Lune laquelle est de -12,9. Et le Soleil apparaît 2,514 fois, soit quelque 400.000, plus brillant que la pleine Lune.
Notez que Véga, une étoile située dans la constellation de la Lyre, constitue la référence de magnitude 0. Sirius, l’étoile la plus brillante de notre ciel, après le Soleil, affiche une magnitude de -1,5. Globalement, les étoiles visibles à l’œil nu présentent des magnitudes apparentes comprises entre -1,5 et 6,5.
Distances et tailles dans le ciel
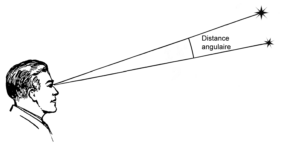
Lorsqu’on observe le ciel, il est courant qu’on veuille évaluer l’écart entre deux astres. On mesure alors la distance angulaire (appelée aussi distance apparente), qui est la valeur de l’angle formé entre les deux droites qui relient ces deux objets à l’observateur comme illustré ci-dessous.
Une distance angulaire se mesure en degrés, minutes et secondes d’arc. Un degré d’arc contient 60 minutes d’arc, et une minute d’arc contient 60 secondes d’arc. Autrement dit, une seconde d’arc est 3 600 fois plus petite qu’un degré d’arc. Par commodité, on omet souvent de préciser « d’arc » derrière ces unités (« la distance mesurée entre ces deux étoiles est de 2 minutes et 30 secondes »).
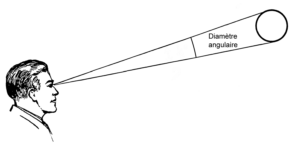
On mesure aussi le diamètre des astres de la même façon, on parle alors de diamètre apparent. Deux objets de taille très différente peuvent avoir la même taille angulaire. Celle de la Lune et du Soleil est d’environ un 31′, mais leur diamètre et leur distance à la Terre diffèrent d’un facteur 400 environ, la Lune étant à 400 000 km et le Soleil à 150 000 000 km.
| Objet | Minimum | Maximum | Moyen en conjonction inférieure |
Moyen en opposition |
|---|---|---|---|---|
| Soleil | 31′ 27″ | 32′ 32″ | ||
| Lune | 31′ 36″ | |||
| Mercure | 0′ 4,5″ | 0′ 13″ | 0′ 11″ | |
| Vénus | 0′ 9,7″ | 1′ 6″ | 1′ 0,2″ | |
| Mars | 0′ 3,5″ | 0′ 25,1″ | 0′ 17,9″ | |
| Jupiter | 0′ 29,8″ | 0′ 50,1″ | 0′ 46,9″ | |
| Saturne | 0′ 14,5″ | 0′ 20,1″ | 0′ 19,5″ | |
| Uranus | 0′ 3,3″ | 0′ 4,1″ | 0′ 3,9″ | |
| Neptune | 0′ 2,2″ | 0′ 2,4″ | 0′ 2,3″ |
Diamètres apparents (en minutes et secondes d’arc) du Soleil, de la Lune et des planètes, observés depuis la Terre
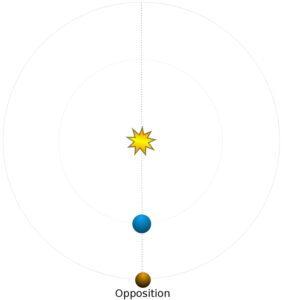
Opposition d’une planète avec un autre astre : C’est un phénomène pour lequel les longitudes célestes géocentriques (ou ascension droite) de la planète et de l’autre astre diffèrent de 180°. L’opposition peut concerner deux planètes mais c’est souvent l’opposition d’une planète et du Soleil qui est recherchée car cette configuration correspond aux conditions les plus favorables d’observation de la planète.
Opposition d’une planète avec le Soleil : cette configuration ne concerne que les planètes supérieures Mars, Jupiter, Saturne, Uranus, Neptune. C’est au moment de l’opposition que la distance entre la planète et la Terre est minimale. Au moment de l’opposition, la planète se lève à peu près quand le Soleil se couche.
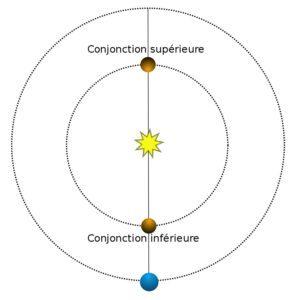
Conjonction entre une planète et un ou plusieurs astres : phénomène dans lequel deux ou plusieurs corps célestes ont des longitudes célestes géocentriques (ou ascensions droites) égales, ce qui signifie que les corps sont au plus près dans le ciel.
Conjonction d’une planète supérieure avec le Soleil : les longitudes célestes géocentriques (ou ascensions droites) de la planète et du Soleil sont égales. Conjonction de Mercure ou Vénus avec le Soleil : les longitudes célestes géocentriques (ou ascensions droites) de la planète et du Soleil sont égales, la conjonction est dite supérieure ou inférieure suivant que le Soleil est entre la Terre et la planète ou que la planète est entre la Terre et le Soleil.
Conjonction de deux planètes entre elles, d’une planète avec la Lune ou avec une étoile : les ascensions droites des deux astres considérés sont égales. La conjonction entre une planète et la Lune est souvent spectaculaire quand la Lune occulte la planète.
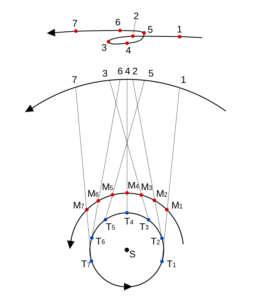
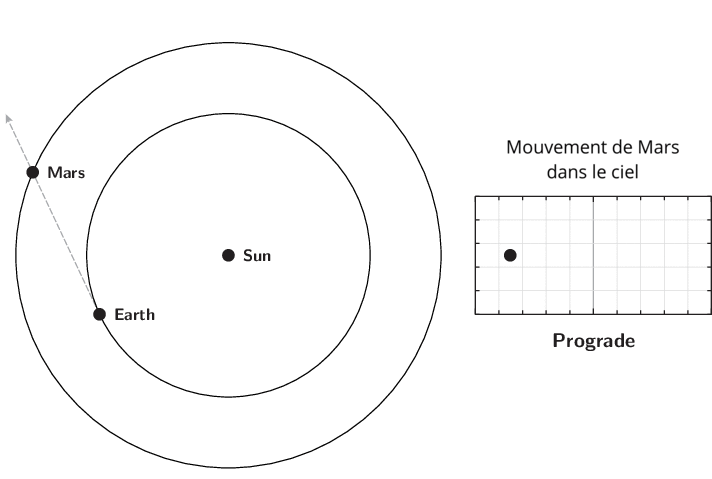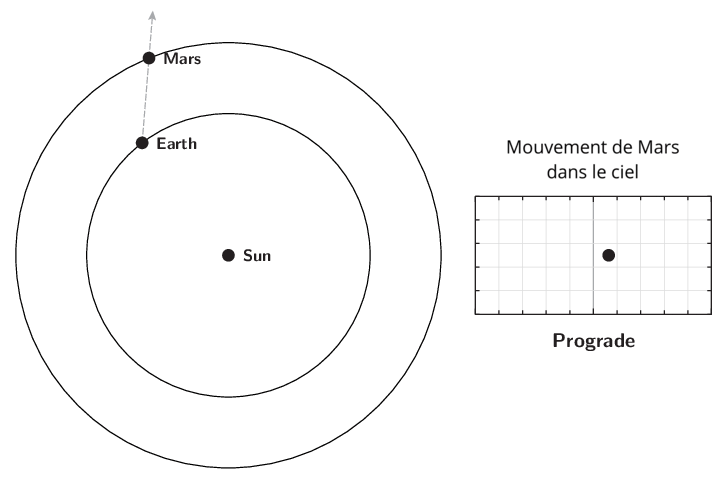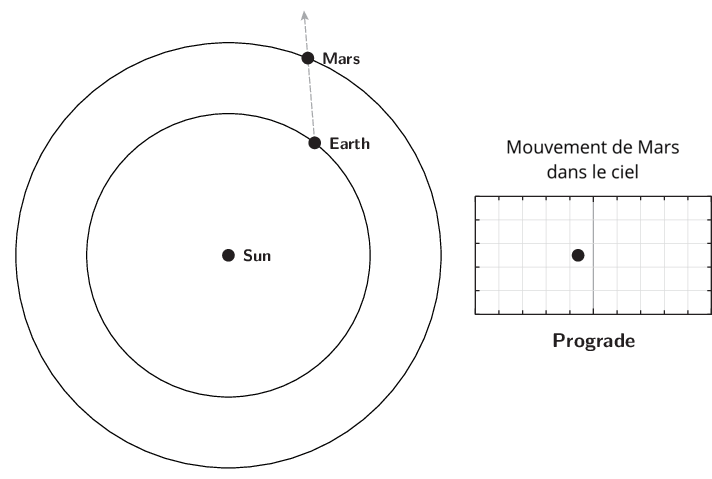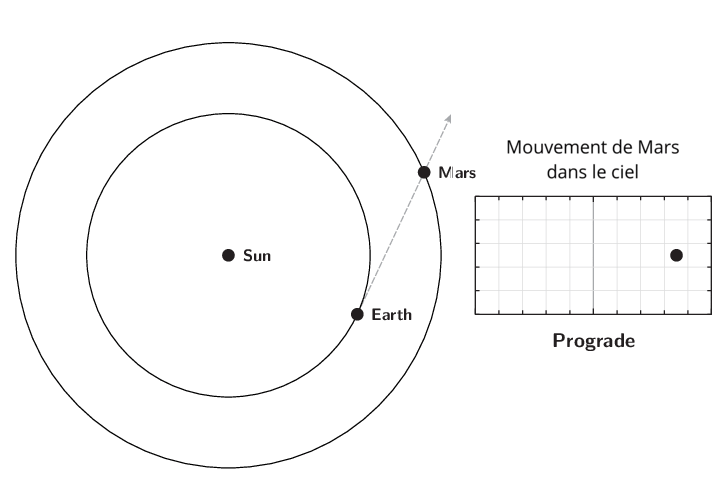
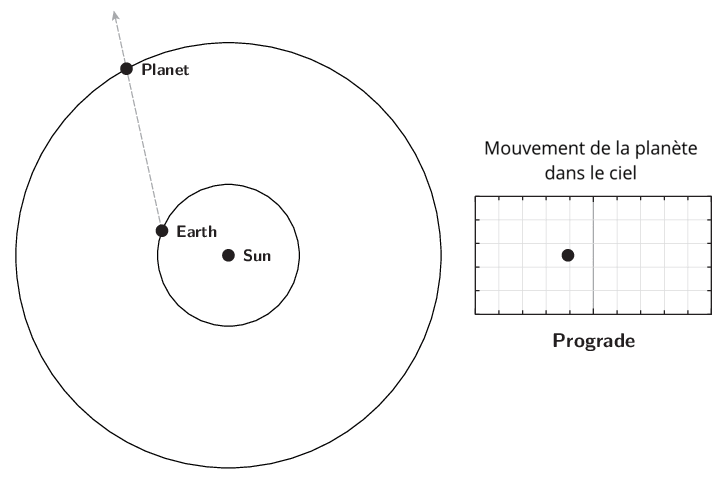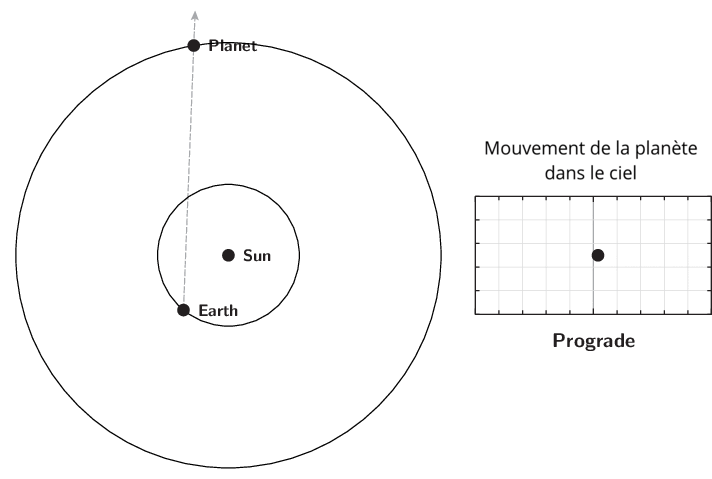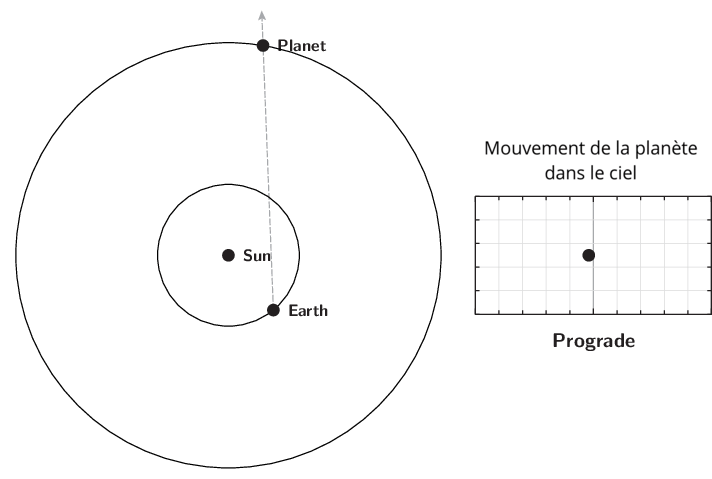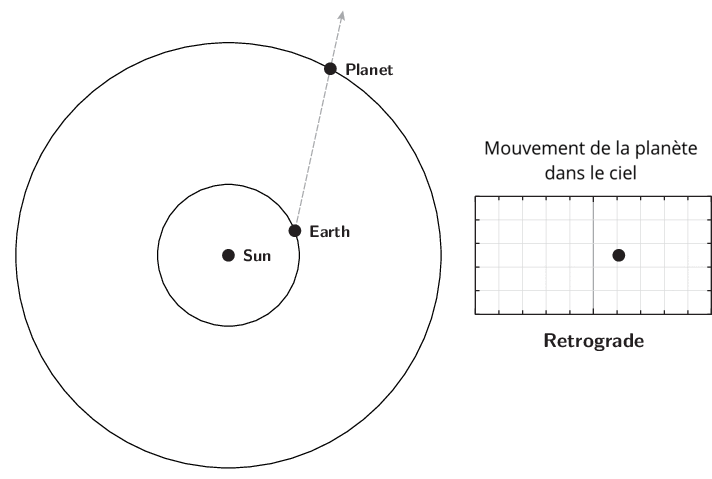
L’observation du mouvement des planètes se fait à partir de la Terre. Le premier déplacement apparent des planètes et des astres est dû à la rotation de la Terre sur elle-même. Il est diurne et s’effectue d’est en ouest. Le Soleil est le premier exemple. Ce n’est pas ce mouvement qui est étudié lors de l’apparition du phénomène de rétrogradation.
Le deuxième mouvement est de l’ordre de l’année ou plus, et est dû aux mouvements de la Terre et des planètes autour du Soleil. Pour l’observer, il faut choisir un référentiel fixe. Ce sera l’ensemble des étoiles lointaines. Cet ensemble était appelé par les astronomes de l’antiquité jusqu’au XVIIIe siècle, la sphère des étoiles fixes. C’est donc par rapport aux étoiles fixes que ce mouvement apparent est mesuré. Observé à partir du Soleil, le mouvement apparent de chaque planète serait circulaire quasi-uniforme. Cependant, la source d’observation étant la Terre, le mouvement de la Terre introduit un biais et les planètes extérieures semblent parfois reculer dans leur mouvement. C’est ce qu’on appelle le mouvement rétrograde. Il s’explique par les différences relatives de vitesse angulaire de chaque astre.
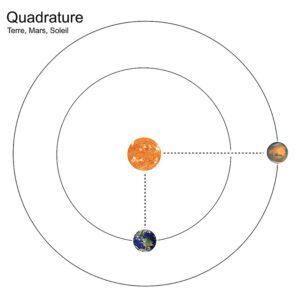
Quadrature d’une planète supérieure avec le Soleil : phénomène pour lequel les longitudes célestes géocentriques (ou ascensions droites) de la planète et du Soleil diffèrent de 90° (configuration pour les planètes supérieures exclusivement).
Qu’appelle-t-on rétrogradation ?
La rétrogradation, ou mouvement rétrograde apparent, est le recul (c’est-à-dire un déplacement dans le sens inverse de son élan moyen habituel à long terme) que semble décrire un corps céleste lors de son observation par rapport aux étoiles lointaines.
L’observation du mouvement des planètes se fait à partir de la Terre. Le premier déplacement apparent des planètes et des astres est dû à la rotation de la Terre sur elle-même. Il est diurne et s’effectue d’est en ouest. Le Soleil est le premier exemple. Ce n’est pas ce mouvement qui est étudié lors de l’apparition du phénomène de rétrogradation.
Le deuxième mouvement est de l’ordre de l’année ou plus, et est dû aux mouvements de la Terre et des planètes autour du Soleil. Pour l’observer, il faut choisir un référentiel fixe. Ce sera l’ensemble des étoiles lointaines. Cet ensemble était appelé par les astronomes de l’antiquité jusqu’au XVIIIe siècle, la sphère des étoiles fixes. C’est donc par rapport aux étoiles fixes que ce mouvement apparent est mesuré. Observé à partir du Soleil, le mouvement apparent de chaque planète serait circulaire quasi-uniforme. Cependant, la source d’observation étant la Terre, le mouvement de la Terre introduit un biais et les planètes extérieures semblent parfois reculer dans leur mouvement. C’est ce qu’on appelle le mouvement rétrograde. Il s’explique par les différences relatives de vitesse angulaire de chaque astre.
 |
 |
Le CNRS propose un dossier sur le Big Bang.
Ce dossier vous propose un voyage dans le temps, de l’explosion primordiale à l’émergence des briques du vivant sur Terre. Astrophysiciens, physiciens des particules, cosmologistes et exobiologistes apportent leur regard et leur expertise sur les grandes étapes de cette fabuleuse histoire qui interroge les hommes depuis la nuit des temps.
Quelques ressources en ligne
La lumière
Qu’est-ce que la lumière blanche ? Pourquoi observe-t-on parfois un arc-en-ciel ? Qu’appelle-t-on la réflexion et la réfraction de la lumière ? Pourquoi utilise-t-on des lunettes pour corriger la vue ?

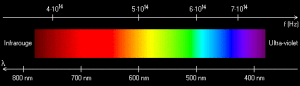
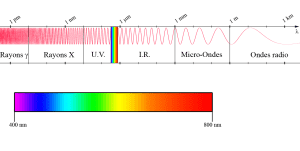
La lumière est l’ensemble des rayonnements électromagnétiques visibles, c’est-à-dire susceptibles d’être perçus directement par un œil humain, dont les longueurs d’onde sont comprises entre 400 et 800 nm.
Toutefois, on étend souvent le domaine de la lumière à des parties invisibles du spectre, l’infrarouge et l’ultraviolet, dont les propriétés restent très voisines de celles de la lumière » visible « .
La lumière blanche est composée de la superposition de toutes les couleurs qui composent le spectre de la lumière « visible ».
Un rayonnement électromagnétique désigne une perturbation des champs électrique et magnétique. En physique classique, il est décrit sous la forme d’une onde électromagnétique correspondant à la propagation d’un champ magnétique et d’un champ électrique (l’un étant perpendiculaire à l’autre) en ligne droite à partir d’une source constituée par un mouvement alternatif de charges électriques. La lumière visible est une petite tranche du large spectre électromagnétique. Dans l’ordre des longueurs d’onde décroissantes, on trouve :
- les ondes radio : λ > 1 m
- les micro-ondes : 1 mm < λ < 1 m
- les infra-rouges : 0,8 µm < λ < 1 mm
- le visible : 0,4 µm < λ < 0,8 µm
- les ultra-violets : 5 nm < λ < 0,4 µm
- les rayons X : 5 pm < λ < 5 nm
- les rayons gamma : λ < 5 pm
La lumière, qui fait partie des premiers phénomènes dont l’homme a pris conscience, a d’abord été étudiée sous l’aspect sensoriel, d’après les images perçues visuellement ; pour certaines études de ce genre (formation des images), on peut assimiler la lumière émise par une source à un faisceau de rayons rectilignes. Mais cette conception simplificatrice (qui suppose, notamment, une longueur d’onde nulle) se révèle incapable de rendre compte de la totalité des phénomènes de propagation de la lumière, et, pour une étude rigoureuse de tous les phénomènes lumineux, on doit recourir à deux théories physiques correspondant au double aspect de la lumière : ondulatoire et corpusculaire.
- La théorie électromagnétique :
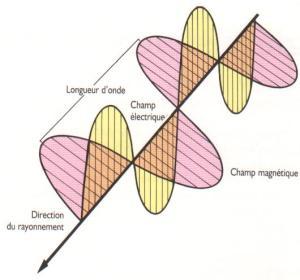
Dans la théorie électromagnétique, la lumière apparaît comme un phénomène ondulatoire périodique (car donnant lieu à des interférences) dont les longueurs d’onde sont de l’ordre de 0,5 µm, pouvant se propager dans le vide avec une vitesse finie, et dont la nature électromagnétique a été établie par les travaux de James Maxwell. En tant qu’onde électromagnétique (onde transversale composée d’une onde de champ électrique et d’une onde de champ magnétique) de fréquence très élevée, la lumière voit sa propagation perturbée, aussi bien par la présence d’obstacles matériels (provoquant des réflexions, des diffractions, des interférences, des réfractions) que par celle de champs électriques ou magnétiques (polarisation rotatoire). Sa vitesse de propagation, dont l’étude cinématique est à l’origine de la théorie de la relativité restreinte, égale à c = 299 792 458 m/s, est une constante universelle dont la valeur n’est pas modifiée par un changement de référentiel ; elle constitue la vitesse maximale de transmission des informations entre deux systèmes quelconques. Mais la théorie électromagnétique (macroscopique), qui décrit correctement les phénomènes de propagation, est insuffisante pour expliquer les interactions de la lumière avec la matière.
- La théorie corpusculaire :
Dans la théorie quantique, la lumière apparaît comme un flux discontinu de photons (particules élémentaires de masse au repos nulle), dont l’énergie est liée à la fréquence de l’onde par la relation W = h . ν (h, constante de Planck ; ν, fréquence) ; ce point de vue permet d’expliquer les observations relatives à l’émission et à l’absorption de lumière par la matière.
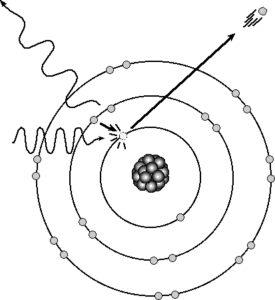
D’une façon générale, l’émission de lumière correspond à la libération de quanta d’énergie (sous forme de photons) par les électrons des atomes retournant à un niveau énergétique inférieur, après avoir été portés à un niveau supérieur par une action excitatrice fournissant l’énergie nécessaire ; suivant la nature de l’excitation, on observe les divers phénomènes d’incandescence ou de luminescence (thermoluminescence, électroluminescence, chimioluminescence, photoluminescence).
L’absorption, quant à elle, correspond à la capture de photons par les électrons des atomes, qui se trouvent ainsi portés à des niveaux excités ; ce qui peut se traduire, notamment, par l’échauffement d’une masse de matière ou par la production d’un courant électrique (effet photoélectrique).
La lumière possède de nombreuses propriétés :
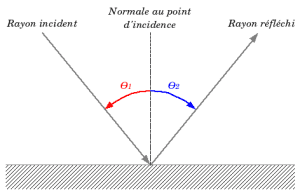
- La réflexion :
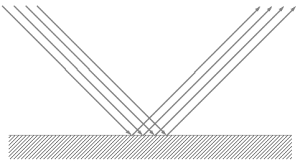
Quand on parle de réflexion, par opposition à l’absorption et à la transmission, il s’agit de l’ensemble des rayons qui émergent de l’interface du côté d’origine des rayons.
Idéalement, l’énergie du rayon incident se retrouve totalement dans le rayon réfléchi, en pratique une partie de l’énergie peut être absorbée ou diffusée au niveau de l’interface.
La qualité de la réflexion dépend de la qualité de l’interface, dès que la taille des défauts de l’interface est inférieure ou de l’ordre de grandeur de la longueur d’onde, l’interface tend à devenir parfaitement réfléchissante. C’est pourquoi une surface de métal brut qui diffuse fortement devient parfaitement réfléchissante quand on la polit (on l’abrase jusqu’à ce que la taille des défauts soit comparable à la longueur d’onde de la lumière).
Si l’on construit un miroir pour la lumière visible, la taille des défauts ne doit pas excéder quelques centaines de nanomètres. Pour les ondes radios ou les ondes radars ces défauts peuvent être de l’ordre de quelques centimètres, au lieu de construire des miroirs dont la surface métallique est uniforme on peut se contenter d’une surface plus grossière de type « grillage ».
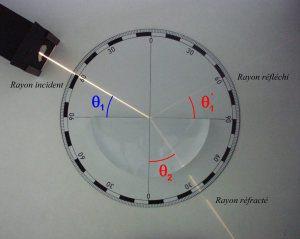
- La réfraction :
La lumière est déviée lorsqu’elle passe d’un milieu transparent à un autre (par exemple : de l’air à l’eau, ou le contraire…). C’est ce phénomène qu’on observe lorsque l’on regarde un crayon dans un verre : celui-ci paraît brisé. Cette fracture apparente est à l’origine du mot réfraction.

Les lois de la réfraction, énoncées par Snell et Descartes, permettent de rendre compte quantitativement du phénomène. Pour la réfraction, les lois de Snell-Descartes précisent que :
- Le rayon réfracté se situe dans le plan d’incidence (défini par le rayon incident et la normale au dioptre au mouvement d’incidence), rayon incident et rayon réfracté étant de part et d’autre de la normale.
- Les angles d’incidence et de réfraction θ1 et θ2, mesurés par rapport à la normale sont tels que : n1.sin θ1 = n2.sin θ2
- La dispersion :
Un milieu est caractérisé par son indice de réfraction n = c/v, où c est la célérité de la lumière dans le vide et v sa vitesse dans le milieu considéré. Une variation de cet indice sur le trajet d’un rayon lumineux va causer sa déviation, ou plutôt réfraction selon les lois de Snell-Descartes.
Ainsi, lorsque le milieu de propagation est dispersif, la vitesse de propagation, et donc l’indice de réfraction dépendent de la fréquence : la déviation des rayons dépend de la fréquence, c’est-à-dire de la couleur. Cela s’observe pour les matériaux comme le verre : les rayons bleus sont plus déviés que les rayons rouges et les couleurs sont ainsi séparées. Cette observation est connue dans le cas des prismes.
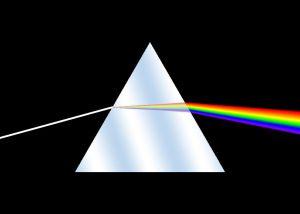
La variation de l’indice de réfraction d’un milieu transparent dans la lumière visible suit une loi dite de Cauchy : n(λ) = A + B/λ2 où λ est la longueur d’onde dans le vide et où A (sans unité) et B (en m2) caractérisent le milieu. On remarque que pour un milieu non dispersif, B = 0 et qu’un milieu est de moins en moins dispersif si B tend vers 0.
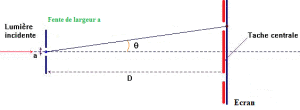
- La diffraction :
La diffraction est le comportement des ondes lorsqu’elles rencontrent un obstacle qui ne leur est pas complètement transparent ; le phénomène peut être interprété par la diffusion d’une onde par les points de l’objet. La diffraction se manifeste par le fait qu’après la rencontre d’un objet, la densité de l’onde n’est pas conservée selon les lois de l’optique géométrique.
La diffraction s’observe avec la lumière, mais également avec le son, les vagues, les neutrons, les rayons X (une onde électromagnétique comme la lumière visible) ou la matière. Elle est une signature de la nature ondulatoire d’un phénomène.
Pour être mise en évidence clairement, l’obstacle que rencontre l’onde doit avoir une taille caractéristique relativement petite par rapport à la distance à laquelle l’observateur se place. Si l’observateur est proche de l’objet, il observera l’image géométrique de l’objet : celle qui nous apparaît habituellement. La diffraction des particules de matière, c’est-à-dire l’observation des particules de matière projetées contre un objet, permet de prouver que les particules se comportent aussi comme des ondes.
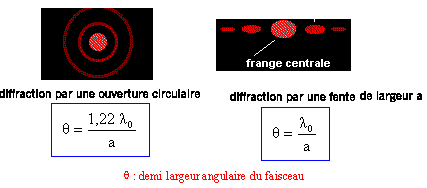
Animations de diffraction par une fente, diffraction par un trou et diffraction par un bord (Source : Académie de Caen).
- Les interférences :
En mécanique ondulatoire, on parle d’interférences lorsque deux ondes de même type se rencontrent et interagissent l’une avec l’autre. Ce phénomène apparaît souvent en optique avec les ondes lumineuses, mais il s’obtient également avec des ondes électromagnétiques d’autres longueurs d’onde, ou avec d’autres types d’ondes comme les ondes sonores.
On utilise des interféromètres pour mesurer ou visualiser les interférences, comme par exemple les fentes de Young. Les fentes de Young désignent une expérience qui consiste à faire interférer deux faisceaux de lumière issus d’une même source, en les faisant passer par deux petits trous percés dans un plan opaque. Sur un écran disposé en face des fentes de Young, on observe une alternance de franges sombres et de franges illuminées.
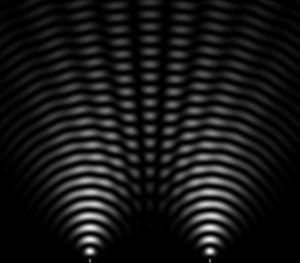
Cette expérience permet alors de mettre en évidence la nature ondulatoire de la lumière. Elle a été également réalisée avec de la matière, comme les électrons, neutrons, atomes, molécules, avec lesquels on observe aussi des interférences. Cela illustre la dualité onde-particule : les interférences montrent que la matière présente un comportement ondulatoire, mais la façon dont ils sont détectés (impact sur un écran) montre leur comportement particulaire.

Voici une animation qui permet de visualiser le phénomène d’interférence de Young (Source : Académie de Caen).
Quelques ressources en ligne
La matière
Qu’est ce que la matière ? Sous quelles formes existe-t-elle ? De quoi est-elle composée ? Comment peut-on la transformée ?
Tout ce que vous avez voulu connaître sur la matière et ses propriétés, découvrez le à travers quelques liens et animations.
La matière désigne l’ensemble des objets et des composés naturels ou synthétiques qui constituent notre univers. Au fil des siècles, les progrès techniques, tels que l’utilisation de microscopes de plus en plus perfectionnés, ont permis aux scientifiques d’observer l’infiniment petit et de percer quelques-uns des secrets de la matière.
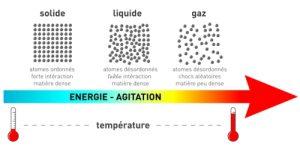
La matière (de mater => mère) est présente autour de nous sous trois formes ou plus exactement trois états : solide, liquide et gazeux. Une substance comme l’eau pourra être de la glace, du liquide incolore ou de la vapeur d’eau selon la température et la pression exercée sur cette eau.
Si on prend un morceau de fer et qu’on le divise en morceaux de plus en plus petits, il arrivera un moment où il ne sera plus possible de le diviser en morceaux de fer. Ce plus petit morceau de fer possible est l’atome de fer.

Un atome de fer peut être divisé mais les morceaux qui restent après la division ne sont plus du fer. On obtient un noyau et des électrons, le noyau étant constitué de protons et de neutrons. Les électrons sont chargé négativement tandis que les protons sont chargés positivement, les neutrons étant électriquement neutres.
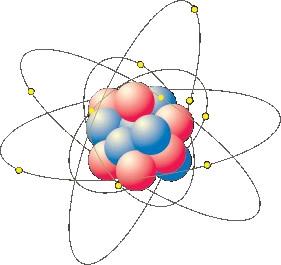
On trouve donc au centre de l’atome le noyau et, autour de ce noyau, le nuage électronique où sont dispersés le électrons. Il y a exactement le même nombre d’électrons et de protons dans un atome, un atome est donc électriquement neutre.
Le volume occupé par le noyau de l’atome est environ 10⁵ fois plus petit que le volume occupé par l’atome. Entre la périphérie de l’atome et le noyau, il y a du vide dans lequel « gravitent » les électrons.
Les atomes sont symbolisés par une lettre majuscule, parfois suivie d’une lettre minuscule. L’atome d’hydrogène est symbolisé par H, celui d’oxygène par O, ou encore l’atome de fer par Fe. Pour décrire complètement l’atome, on a besoin, d’une part, du numéro atomique Z, c’est à dire du nombre de protons dans le noyau, et, d’autre part, du nombre de masses A, c’est à dire du nombres de nucléons (protons + neutrons) dans le noyau. La représentation symbolique d’un atome est alors :

Le nombre de neutrons d’un atome est alors égal à A-Z.
L’atome d’or : 
- Au est le symbole chimique de l’or,
- 197 : le noyau contient 197 nucléons,
- 79 : le noyau contient 79 protons et l’atome 79 électrons,
- 197-79 = 118 : le noyau contient donc 118 neutrons.
L’atome d’or est donc composé de 118 neutrons, 79 protons et 79 électrons.
Les éléments chimiques sont classifiés selon leur nombre atomique croissant et en fonction de leur configuration électronique dans le tableau périodique des éléments.
Son invention est généralement attribuée au chimiste russe Dmitri Mendeleïev, qui construisit en 1869 une table différente de celle qu’on utilise aujourd’hui[1] mais similaire dans son principe, dont le grand intérêt était de proposer une classification systématique des éléments chimiques connus à l’époque en vue de souligner la périodicité de leurs propriétés chimiques, d’identifier les éléments qui restaient à découvrir, et même de pouvoir prédire les propriétés de ces éléments alors inconnus.
Le tableau périodique a connu de nombreux réajustements depuis lors jusqu’à prendre la forme que nous lui connaissons aujourd’hui, et est devenu un référentiel universel auquel peuvent être rapportés tous les types de comportements physique et chimique des éléments.
Si on prend de l’eau et qu’on la divise en parties de plus en plus petites, il arrivera aussi un moment où il ne sera plus possible de la diviser en parties d’eau. La plus petite partie d’eau possible est la molécule d’eau. La molécule d’eau peut être divisée mais les morceaux qui restent après la division ne sont plus de l’eau : ce sont un atome d’oxygène et deux atomes d’hydrogène (la molécule d’eau est donc notée H2O)…

Ainsi, il est possible de faire de l’eau avec de l’oxygène et de l’hydrogène, au cours d’une réaction chimique. Par contre, il n’est pas possible de faire du fer par une réaction chimique (mais il est possible d’extraire du fer d’une molécule qui en contient).
Une molécule est donc un assemblage de plusieurs atomes. Certains corps, tels que l’eau, sont des corps composés, leur plus petite partie est une molécule, d’autres, comme le fer, sont des corps purs, leur plus petite partie est un atome. La chimie permet de faire des corps composés à partir de corps purs, mais pas de faire des corps purs à partir d’autres corps purs…
Les grecs anciens, et en particulier Démocrite, avaient déjà imaginé que la matière devait être discrète et non continue, c’est à dire qu’elle ne peut pas être divisée indéfiniment. Ils avaient ainsi postulé l’existence de grains de matière indivisibles qu’ils appelèrent atomes (atomos en grec signifie insécable). Néanmoins, pendant des siècles, l’idée généralement admise était que toute matière pouvait être formée à partir de quatre éléments fondamentaux : l’eau, l’air, la terre et le feu…
Les notions modernes d’éléments et d’atomes sont apparues plus tard avec les débuts de la chimie. La notion d’élément telle qu’elle est connue actuellement a été définie en 1661 par Robert Boyle. Ensuite, John Dalton en 1808 et Avogadro en 1811 élaborèrent la notion d’atome et de molécule afin d’expliquer les réactions chimiques, mais ce schéma ne fut adopté officiellement qu’en 1860.
Il fallut attendre la fin du XIXème siècle pour que l’atome soit aussi étudié par les physiciens et pas seulement par les chimistes.
- Les Gaz
Un gaz est un ensemble d’atomes ou de molécules très faiblement liés et quasi-indépendants. Dans l’état gazeux, la matière n’a pas de forme propre ni de volume propre : un gaz tend à occuper tout le volume disponible. L’état gazeux est un état désordonné et dispersé et est une forme de fluide.

- Les Liquides
Le liquide est une forme de fluide : les molécules sont faiblement liées, ce qui rend les liquides parfaitement déformables ; ils n’ont donc pas de forme propre. Mais, à l’inverse du gaz, elles sont tout de même liées : une molécule ne peut s’éloigner beaucoup d’une autre, ce qui fait que la matière liquide a une cohésion que ne possède pas le gaz. Les molécules étant très proches les unes des autres, les liquides sont difficilement compressibles, ils ont un volume propre. L’état liquide est un état désordonné et dense.

La forme liquide correspond à une forme de moindre énergie que le gaz (l’énergie cinétique des molécules d’un liquide est insuffisante pour rompre les forces qui se matérialisent par la tension superficielle) mais d’énergie supérieure à la forme solide (contrairement au solide, l’énergie cinétique des molécules suffit à les faire se déplacer spontanément les unes par rapport aux autres).
Une caractéristique des liquides est leur viscosité, qui mesure l’attachement des molécules les unes aux autres – et donc la résistance à un corps qui traverserait le liquide. Plus la viscosité est grande, plus le liquide est difficile à traverser. Il y a donc toute une gamme d’états intermédiaires (pâte), qui rend la distinction difficile entre le liquide et le solide. L’hélium II (« superfluide ») ne possède pas de viscosité du tout.
- Les Solides
L’état solide est un des états de la matière caractérisé par l’absence de liberté entre les particules qui le constitue (atomes, ions, molécules). Les solides ont un volume propre comme les liquides, mais également une forme propre.

La plupart des solides sont des cristaux, et le modèle du cristal permet de se faire une bonne idée de l’état solide : les atomes sont disposés dans l’espace de manière régulière et ordonnée. Les distances entre les atomes restent constantes. On parle d’ordre à longue distance. C’est le domaine de la cristallographie. On distingue quatre types de solides cristallisés :
- les solides métalliques constitués d’ions positifs simples (atomes ayant perdu 1 ou 2 électrons périphériques) baignant dans un » gaz » d’électrons libres ou quasi-libres
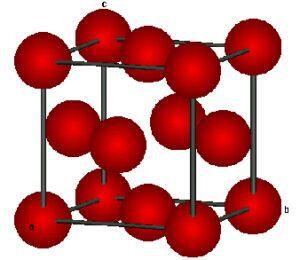
- les solides ioniques constitués d’ions positifs et négatifs
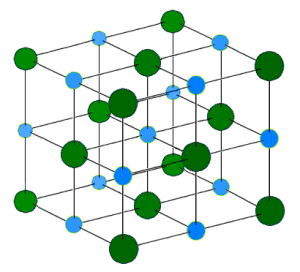
- les solides covalents qui sont isolants ou semi-conducteurs
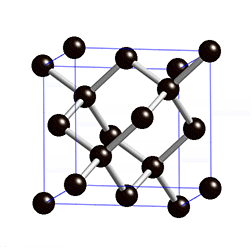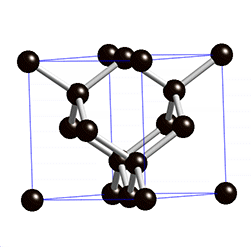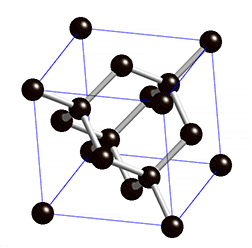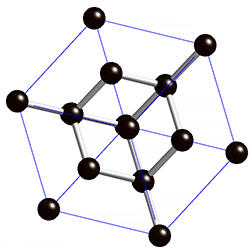
- les solides moléculaires où des interactions (type Van der Waals) expliquent la cohésion
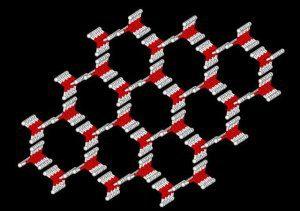
Cependant, certains solides sont amorphes : ils n’ont pas d’atomes rangés régulièrement comme dans un cristal. Les atomes ne respectent aucun ordre à moyenne et grande distance. Le cas typique est celui du verre qui, à température ordinaire, a l’apparence d’un solide très dur et indéformable. Lorsqu’on augmente la température, il fond sans qu’il y ait discontinuité dans les propriétés physiques, c’est à dire sans qu’il y ait de changement dans la structure atomique. C’est un solide appelé solide vitreux où l’état solide est en fait un état liquide (donc une structure désordonnée) de viscosité très élevée. Les solides amorphes ont tout de même un ordre à courte distance (de quelques atomes).
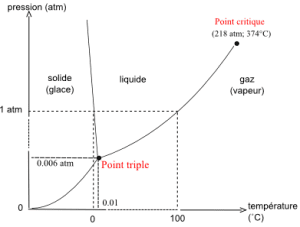
Un changement d’état est une transition de phase lors du passage d’un état de la matière à un autre. Attention : un changement d’état n’est pas une transformation chimique ! Ce phénomène est étudié en thermodynamique via les diagrammes de phase. La transition de phase se produit lorsque certaines caractéristiques de la matière changent : pression, température, volume, densité, énergie, etc.
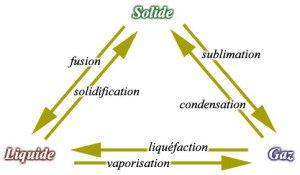
À pression atmosphérique normale, l’eau est solide pour une température inférieure à 0 °C, liquide pour une température comprise entre 0 °C et 100 °C, et à l’état de gaz pour des températures supérieures. À pression plus faible, le changement d’état se produit pour des températures plus basses. Ainsi, l’eau bout à une température inférieure à 100 °C en montagne car la pression diminue avec l’altitude.
Quelques ressources en ligne